Abstract
Background
La trasmissione di patogeni tramite zanzare è significativamente influenzata dalla frequenza di contatto tra zanzare e ospiti suscettibili. I tassi di puntura delle zanzare sono influenzati da vari fattori, tra cui le specie di zanzare e le caratteristiche dell’ospite come odore, calore e comportamento. Tuttavia, le caratteristiche dell’ospite che causano variazioni nei tassi di puntura delle zanzare all’interno delle specie non sono ben comprese. Questo studio ha indagato l’impatto di tre tratti correlati all’ospite: sesso, massa corporea e stato di infezione da malaria aviaria (Plasmodium) sui tassi di puntura di due specie di zanzare con diverse preferenze alimentari: la Culex pipiens, che predilige gli uccelli, e l’Ochlerotatus (Aedes) caspius, che predilige i mammiferi. Abbiamo esposto individualmente settantadue taccole (Corvus monedula) e 101 passeri domestici (Passer domesticus) alle punture di zanzara per valutare come questi tratti dell’ospite influenzano i tassi di puntura.
Risultati
L’Ochlerotatus caspius ha punto le taccole a tassi significativamente più elevati rispetto alla Cx. pipiens, ma non è stata osservata alcuna differenza significativa sui passeri domestici. In particolare, l’Oc. caspius si è nutrito più sulle taccole femmine rispetto ai maschi, mentre la Cx. pipiens non ha mostrato tale preferenza. Nel corso dell’anno, i tassi di puntura delle zanzare sui passeri domestici sono aumentati. Tuttavia, lo stato di infezione e la massa corporea di entrambe le specie di uccelli non erano correlati ai tassi di puntura di entrambe le specie di zanzare.
Conclusioni
Il sesso dell’ospite sembra essere un tratto correlato all’ospite che può influenzare i tassi di puntura delle zanzare, ma questo effetto può variare a seconda della specie di zanzara e dell’ospite coinvolti.
Parole chiave: Aedes, Malaria aviaria, Culex pipiens, Haemosporidi, Modelli di alimentazione delle zanzare, Ochlerotatus caspius, Uccelli selvatici
Background
Il comportamento di alimentazione ematica delle zanzare è un processo complesso che coinvolge più fasi. La ricerca e l’individuazione dell’ospite iniziano con l’integrazione di segnali chimici (ad esempio, CO2, odori) e segnali visivi (ad esempio, dimensioni dell’ospite e colorazione del piumaggio/pelliccia) emessi dall’ospite [1, 2]. Più vicino all’ospite, l’odore, il calore e il comportamento difensivo dell’ospite possono influenzare la selezione finale dell’ospite e il successo dell’alimentazione ematica delle zanzare [3].
Le zanzare mostrano preferenze alimentari innate in condizioni naturali. Alcune specie si nutrono principalmente di mammiferi (mammofile, con alcune antropofile), mentre altre preferiscono uccelli (ornitofile), anfibi o rettili. Alcune specie mostrano abitudini alimentari più opportunistiche [4–8]. Oltre a queste ampie preferenze, le zanzare pungono alcune specie ospiti più spesso del previsto in base alla loro abbondanza [9–11]. Ad esempio, Kilpatrick et al. [9] hanno dimostrato che i pettirossi americani (Turdus migratorius) venivano punti più frequentemente dalle zanzare Culex pipiens rispetto agli storni europei (Sturnus vulgaris) in Nord America. Allo stesso modo, in Europa, la Cx. pipiens preferiva i merli (Turdus merula) rispetto agli storni europei [12]. All’interno delle specie ospiti, alcuni individui possono ricevere un numero sproporzionato di punture di zanzara, agendo potenzialmente come superdiffusori quando infettati da patogeni trasmessi da vettori [13].
Questa variazione nell’attrazione delle zanzare e nell’uso dell’ospite può avere un impatto significativo sulle dinamiche di trasmissione dei parassiti che causano malattie umane e animali [14]. Questi fattori possono influenzare il successo della trasmissione di parassiti come protozoi (ad esempio, Plasmodium spp.) e vermi filari (ad esempio, Dirofilaria spp.) [2, 15].
Diversi meccanismi non esclusivi possono portare un singolo ospite a ricevere più punture di zanzara. Questi includono l’utilizzo di habitat con densità di zanzare più elevate, l’emissione di segnali attrattivi più forti o l’esibizione di un comportamento antizanzara meno efficace rispetto ad altri della loro specie [7]. Gli ospiti più grandi (cioè con una massa corporea maggiore, un proxy per le dimensioni del corpo) potrebbero anche attrarre più punture di zanzara [16], probabilmente a causa di una maggiore emissione di segnali come la CO2 [17]. Studi tra le specie hanno mostrato una correlazione positiva tra la massa corporea dell’ospite e il tasso di alimentazione di vari insetti succhiatori di sangue [18, 19]. Tuttavia, le indagini sperimentali sulla relazione tra la variazione della massa corporea all’interno delle specie e i tassi di alimentazione delle zanzare sono limitate [20]. Inoltre, i tratti morfologici, fisiologici e/o comportamentali specifici per sesso potrebbero portare a differenze nell’attrazione dei vettori [21]. Queste differenze nell’attrazione dei vettori basate sul sesso sono state proposte come una possibile spiegazione per la maggiore prevalenza di parassiti del sangue spesso osservata negli uccelli maschi rispetto alle femmine [22–24]. Tuttavia, Burkett-Cadena et al. [25] sono tra i pochi che hanno valutato l’effetto del sesso degli uccelli sulle preferenze di puntura delle zanzare. La loro analisi delle origini del pasto di sangue delle zanzare ha rivelato una propensione verso gli uccelli maschi, ma solo nelle zanzare mammifile. Le ragioni alla base di queste differenze rimangono poco chiare. I modelli osservati da Burkett-Cadena et al. [25] potrebbero derivare da una diversa suscettibilità, attrazione e/o esposizione dei sessi degli uccelli agli attacchi delle zanzare, o semplicemente da un rapporto sbilanciato tra i sessi degli uccelli nelle aree di cattura delle zanzare. Infine, lo stato di infezione di un ospite con parassiti trasmessi da vettori può anche influenzare i modelli di puntura delle zanzare, potenzialmente influenzando la trasmissione di agenti patogeni [26, 27]. Ad esempio, gli esseri umani infettati da Plasmodium vivax sono risultati più attraenti per i vettori di zanzare [28]. Tuttavia, gli studi sul Plasmodium aviario sono meno conclusivi. Mentre Cornet et al. [26, 27] hanno riportato che la Cx. pipiens, un importante vettore del Plasmodium aviario, punge preferenzialmente gli uccelli cronicamente infetti, altri studi hanno riportato il contrario [29] o nessuna differenza significativa tra uccelli infetti e non infetti [30].
In questo studio, abbiamo esaminato sperimentalmente l’impatto di tre tratti correlati all’ospite (massa corporea, sesso e stato di infezione da Plasmodium aviario) sui modelli di alimentazione delle zanzare, eliminando il comportamento antizanzara dell’ospite. Abbiamo utilizzato due specie di zanzare con diverse preferenze alimentari: la Cx. pipiens ornitofila e l’Ochlerotatus (Aedes) caspius mammifilo [8, 31, 32], e due specie di uccelli come modelli ospiti: la taccola (Corvus monedula) e il passero domestico (Passer domesticus), entrambi ospiti comuni dei parassiti della malaria aviaria [33, 34]. Sulla base di ricerche precedenti [19, 25–27], abbiamo ipotizzato: (i) tassi di puntura più elevati sugli uccelli da parte della Cx. pipiens ornitofila rispetto all’Oc. caspius mammifilo; (ii) aumento dei tassi di puntura delle zanzare sugli uccelli più pesanti; (iii) tassi di puntura più elevati sugli uccelli maschi rispetto alle femmine, in particolare per l’Oc. caspius; e (iv) tassi di puntura elevati sugli uccelli infetti da Plasmodium rispetto agli uccelli non infetti.
Metodi
Raccolta e allevamento delle zanzare
Le larve di Culex pipiens e Oc. caspius sono state raccolte da marzo ad agosto nel 2014 e nel 2016 dalla riserva naturale “La Cañada de los Pájaros” (36°57′N, 6°14′W; provincia di Siviglia, Spagna) e dalle paludi della provincia di Huelva (37°17′N, 6°53′W), rispettivamente. Le larve sono state trasportate in laboratorio e mantenute in vaschette di plastica con acqua dolce o salmastra, rispettivamente, e alimentate ad libitum con Mikrozell 20 ml/22 g (Dohse Aquaristik GmbH & Co. KG, Gelsdorf, Germania). Le larve e le zanzare adulte sono state tenute in condizioni standard (28 ± 1 °C, 65-70% di umidità relativa e fotoperiodo 12:12 luce:buio). Le zanzare adulte sono state anestetizzate con etere e identificate per sesso e specie in base alla morfologia utilizzando uno stereomicroscopio (Nikon SMZ645, Tokyo, Giappone) su capsule di Petri refrigerate, seguendo Schaffner et al. [35]. Dopo l’identificazione, le femmine adulte sono state collocate in gabbie per insetti (BugDorm-43030F, 32,5 × 32,5 × 32,5 cm; MegaView Science Co, Taichung, Taiwan) e fornite di soluzione zuccherina all’1% ad libitum. La soluzione zuccherina è stata rimossa 24 ore prima di ciascun esperimento. Le colonie di laboratorio sono state evitate per ridurre al minimo gli effetti della selezione artificiale sulle preferenze di puntura [36, 37].
Campionamento degli uccelli e procedura sperimentale
La taccola è un uccello passeriforme non migratore presente in Europa, Asia occidentale e Nord Africa, che misura 34-39 cm di lunghezza e pesa 181-257 g. Questa specie non mostra dimorfismo sessuale. Il passero domestico, anch’esso un passeriforme non migratore originario della maggior parte dell’Europa, è lungo 14-18 cm con una massa corporea di 21-31 g. Mentre la massa corporea è simile tra i sessi, gli adulti mostrano un forte dimorfismo sessuale nella colorazione del piumaggio [38].
Le taccole sono state catturate da marzo a luglio 2014 a “La Cañada de los Pájaros” utilizzando trappole walk-in, e i passeri domestici sono stati catturati utilizzando reti da nebbia da aprile ad agosto 2014 nella stessa località e da giugno ad agosto 2016 in varie località della provincia di Huelva. Gli uccelli sono stati inanellati individualmente con anelli metallici numerati, pesati e sono stati prelevati campioni di sangue dalla vena giugulare utilizzando siringhe sterili. Il volume di sangue variava a seconda della specie a causa delle differenze di massa corporea (1 ml nelle taccole, 0,2 ml nei passeri domestici). Gli uccelli femmine con chiazze di covata sono stati immediatamente rilasciati ed esclusi dallo studio per ridurre al minimo l’impatto sulla riproduzione. Le prove di alimentazione sperimentali sono state condotte dalle 7:30 alle 12:00 h (GMT + 1 h).
I singoli uccelli sono stati confinati per 30 minuti in una gabbia per insetti (BugDorm-43030F, 32,5 × 32,5 × 32,5 cm, MegaView Science Co, Taichung, Taiwan) contenente 53 ± 33,7 (media ± DS) (intervallo 1-152) zanzare femmine di Cx. pipiens o Oc. caspius. Le prove si sono svolte in un ambiente tranquillo e con scarsa illuminazione per ridurre al minimo le alterazioni comportamentali. Studi precedenti hanno dimostrato che le specie di zanzare, inclusa la Cx. pipiens, possono nutrirsi di uccelli in gabbia [39, 40]. Ogni uccello è stato immobilizzato per prevenire comportamenti difensivi contro le zanzare. Le taccole sono state immobilizzate utilizzando nastro adesivo non permanente per attaccare le ali al corpo, chiudere il becco e tenere insieme le zampe, lasciando esposte le aree non piumate (zampe e occhi) per l’alimentazione delle zanzare. I passeri domestici sono stati immobilizzati in un cilindro a maglie da 1 × 1 cm, consentendo alle zanzare di mordere attraverso. Dopo le prove, gli uccelli sono stati rilasciati nel loro luogo di cattura senza danni apparenti. Le zanzare con pasti di sangue recenti, inclusi ingorghi parziali e completi, sono state contate e classificate come alimentate con sangue.
Analisi molecolari
Il DNA genomico è stato estratto da campioni di sangue di uccelli utilizzando il Maxwell® 16 LEV Blood DNA Kit (Promega, Madison, WI, USA) [41]. Gli uccelli sono stati sessati molecolarmente seguendo Griffiths et al. [42]. Lo stato di infezione da Plasmodium aviario è stato valutato amplificando un frammento di 478 bp del gene mitocondriale del citocromo b seguendo Hellgren et al. [43]. La presenza di ampliconi è stata verificata in gel di agarosio all’1,8% e i campioni positivi sono stati sequenziati utilizzando la tecnologia BigDye (Applied Biosystems, Foster City, CA, USA) o il servizio di sequenziamento Macrogen (Macrogen Inc., Amsterdam, Paesi Bassi). Le sequenze sono state modificate utilizzando il software Sequencher™ v.4.9 (Gene Codes Corp., Ann Arbor, MI, USA) e assegnate al genere di parassita confrontandole con il database GenBank (National Centre for Biotechnology Information). Sono stati inclusi solo gli uccelli infettati da Plasmodium aviario; gli uccelli infetti o co-infetti con Haemoproteus o Leucocytozoon sono stati esclusi.
Il verificarsi di biotipi di Cx. pipiens nell’area di raccolta delle larve (La Cañada de los Pájaros) è stato caratterizzato in un altro studio. Abbiamo analizzato 140 zanzare amplificando la regione fiancheggiante 5′ del microsatellite CQ11 seguendo [44, 45], trovando Cx. p. pipiens, Cx. p. molestus e ibridi (frequenza del 45%, 10,7% e 44,3%, rispettivamente). I biotipi di zanzare in questo studio non sono stati analizzati a causa delle grandi dimensioni del campione.
Analisi statistica
I test del chi quadrato hanno confrontato la proporzione di zanzare che hanno punto i passeri domestici e le taccole separatamente per ciascuna specie di zanzara. Modelli lineari misti generalizzati (GLMM) con errore binomiale e funzione di collegamento logit sono stati utilizzati per valutare gli effetti delle specie di zanzare e delle caratteristiche degli uccelli sui tassi di puntura delle zanzare, utilizzando il software R v.3.2.5 [46] con il pacchetto lme4 [47]. In primo luogo, abbiamo confrontato i tassi di puntura delle due specie di zanzare sugli uccelli. I modelli utilizzavano il tasso di puntura delle zanzare come variabile dipendente, espresso come il numero di zanzare che hanno punto rispetto a quelle che non lo hanno fatto, utilizzando la funzione cbind. Modelli separati sono stati adattati per le taccole e i passeri domestici a causa delle differenze nel metodo di immobilizzazione e delle variazioni delle dimensioni del corpo. Ogni modello includeva la massa corporea degli uccelli e la data della prova (giorno 1 = 1 gennaio) come covariate, e il sesso degli uccelli, lo stato di infezione da Plasmodium (infetto/non infetto) e le specie di zanzare (Cx. pipiens/Oc. caspius) come fattori fissi. Per i passeri domestici, catturati in due anni, l’anno è stato incluso come fattore fisso. Sono state incluse anche le interazioni bidirezionali tra le specie di zanzare e il sesso dell’ospite e tra le specie di zanzare e lo stato di infezione. L’identità dell’uccello era un termine casuale per correggere la sovradispersione (parametro di dispersione > 7,21) [48]. La massa corporea e la data sono state scalate per ciascuna specie per deviazione standard e centrate sulla media per la normalizzazione. Un esperimento di trattamento farmacologico sulle taccole (primaquina o controllo) non ha influenzato il tasso di puntura delle zanzare (Z = -1,2, Stima = -0,62, P = 0,26), quindi questo fattore è stato escluso da ulteriori analisi. Il potenziale effetto di diversi ceppi di Plasmodium sui tassi di puntura non è stato analizzato a causa delle piccole dimensioni del campione per le diverse combinazioni di specie uccello/zanzara (Tabella 1).
Tabella 1.
Numero di individui infettati con ciascun ceppo di Plasmodium in questo studio
| Ceppi di Plasmodium | Taccole | Passeri domestici | |—|—|—|—|—|—| | | Cx. pipiens | Oc. caspius | Cx. pipiens | Oc. caspius | | SGS1 | 21 | 5 | 17 | 13 | | GRW11 | 7 | 2 | | | | COLL1 | 6 | 2 | | | | PADOM01 | 3 | 2 | | | | DELURB5 | 2 | 1 | | | | PADOM02 | 3 | | | | | GRW4 | 1 | | | | | Totale infetti | 30 | | 55 | |
Risultati
Lo studio ha incluso 72 taccole (34 maschi, 38 femmine) e 101 passeri domestici (66 maschi, 35 femmine). L’infezione da Plasmodium aviario era presente in 30 taccole (41,7%) e 55 passeri domestici (54,5%). Sono stati identificati sette ceppi di Plasmodium (Tabella 1). Sono state utilizzate un totale di 9153 zanzare femmine: 6387 Cx. pipiens e 2766 Oc. caspius. Di queste, 630 (9,9%) Cx. pipiens e 633 (22,9%) Oc. caspius si sono nutrite di sangue (Tabella 2), tra cui 294 (46,7%) Cx. pipiens e 436 (68,9%) Oc. caspius su taccole e 336 (53,3%) Cx. pipiens e 197 (31,1%) Oc. caspius su passeri domestici (Tabella 2).
Tabella 2.
Dati di sintesi delle zanzare che pungono taccole e passeri domestici utilizzati in questo studio rispetto al sesso dell’ospite e allo stato di infezione da parassiti del Plasmodium aviario
| n | Numero di zanzare in ciascun test per scatola (media ± ES) | Numero di zanzare ingorgate per scatola (media ± ES) | |—|—|—|—|—|—| | Taccole | | | | | | | Cx. pipiens | Sesso | Maschio | 26 | 59,1 ± 6,5 | 7,0 ± 2,6 | | | Femmina | 29 | 49,7 ± 6,2 | 3,6 ± 1,0 | | | Stato infettivo | Non infetto | 32 | 58,7 ± 5,9 | 4,9 ± 2,9 | | | | Infetto | 23 | 47,8 ± 7,1 | 6,0 ± 3,5 | | Oc. caspius | Sesso | Maschio | 8 | 62,9 ± 12,0 | 17,0 ± 4,8 | | | Femmina | 9 | 58,1 ± 11,2 | 33,5 ± 6,2 | | | Stato infettivo | Non infetto | 10 | 71,9 ± 10,7 | 21,3 ± 5,8 | | | | Infetto | 7 | 45,9 ± 12,8 | 30,3 ± 7,3 | | Passeri domestici | | | | | | | Cx. pipiens | Sesso | Maschio | 41 | 57,3 ± 5,4 | 4,9 ± 0,9 | | | Femmina | 20 | 53,0 ± 7,7 | 6,9 ± 1,3 | | | Stato infettivo | Non infetto | 25 | 52,0 ± 6,8 | 4,6 ± 1,2 | | | | Infetto | 36 | 58,6 ± 5,8 | 6,2 ± 1,0 | | Oc. caspius | Sesso | Maschio | 25 | 44,4 ± 6,8 | 4,2 ± 1,2 | | | Femmina | 15 | 41,7 ± 9,4 | 6,1 ± 1,6 | | | Stato infettivo | Non infetto | 21 | 32,7 ± 7,5 | 3,6 ± 1,3 | | | | Infetto | 19 | 55,2 ± 8,2 | 6,4 ± 1,4 |
L’Oc. caspius ha punto le taccole a un tasso più elevato rispetto ai passeri domestici (χ2 = 15,43, df = 1, P < 0,001), mentre la Cx. pipiens non ha mostrato differenze significative (χ2 = 0,04, df = 1, P = 0,84; Fig. 1). L’Oc. caspius mammifilo ha avuto un tasso di puntura significativamente più elevato rispetto alla Cx. pipiens ornitofila (Z = 4,22, Stima = 1,00, P < 0,001; Fig. 1).
Fig. 1.
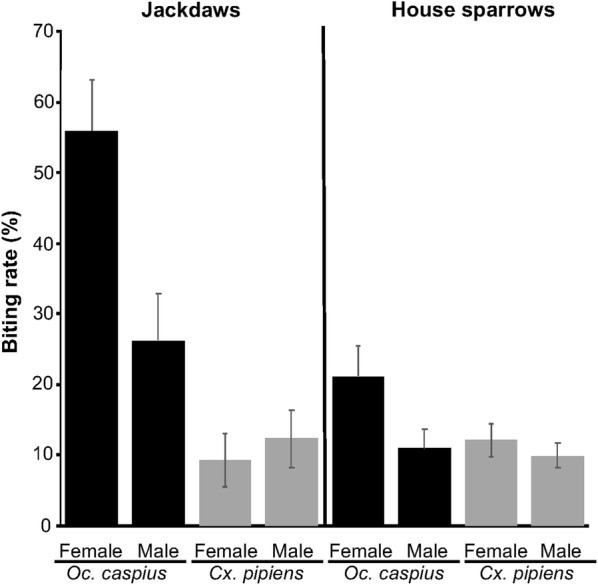 Tassi di puntura delle zanzare Ochlerotatus caspius e Culex pipiens su taccole e passeri domestici femmine e maschi
Tassi di puntura delle zanzare Ochlerotatus caspius e Culex pipiens su taccole e passeri domestici femmine e maschi
Tassi di puntura delle zanzare Ochlerotatus caspius e Culex pipiens su taccole e passeri domestici femmine e maschi.
Gli effetti delle caratteristiche degli uccelli sui tassi di puntura delle zanzare sono stati analizzati separatamente per ciascuna specie di uccello a causa delle differenze metodologiche (immobilizzazione) e delle variazioni di dimensioni. Per le taccole, l’Oc. caspius ha avuto tassi di puntura significativamente più elevati rispetto alla Cx. pipiens (Tabella 3). L’Oc. caspius ha anche punto le taccole femmine più dei maschi, mentre la Cx. pipiens non ha mostrato differenze significative basate sul sesso (Tabella 3, Fig. 1). Lo stato di infezione dell’ospite, la massa corporea e la data non erano significativamente correlati ai tassi di puntura delle zanzare sulle taccole (Tabella 3). Per i passeri domestici, i tassi di puntura non differivano significativamente tra Cx. pipiens e Oc. caspius. La data è stata l’unica variabile significativa, con i tassi di puntura che aumentavano con il progredire della stagione. Il sesso dell’ospite, la massa corporea e lo stato di infezione non erano significativamente correlati ai tassi di puntura delle zanzare sui passeri domestici (Tabella 3, Fig. 1).
Tabella 3.
Risultati dei GLMM che analizzano i tassi di puntura delle zanzare in relazione alle specie di zanzare (Ochlerotatus caspius e Culex pipiens) e alla massa corporea degli uccelli, al sesso, allo stato di infezione da Plasmodium, alla data in cui è stata condotta ciascuna prova e all’anno di cattura degli uccelli. Gli effetti significativi sono evidenziati in grassetto.
| Variabili esplicative | Taccole | Passeri domestici | |—|—|—|—|—|—|—|—| | | Stima | ES | Valore Z- | Valore P- | Stima | ES | Valore Z- | Valore P- | | Specie di zanzare | 2,51 | 0,56 | 4,50 | < 0,001 | 0,51 | 0,54 | 0,94 | 0,35 | | Massa corporea | 0,75 | 0,82 | 0,92 | 0,36 | 1,46 | 0,80 | 1,84 | 0,07 | | Sesso | 0,04 | 0,39 | 0,10 | 0,92 | -0,57 | 0,36 | -1,59 | 0,11 | | Stato di infezione | 0,03 | 0,36 | 0,07 | 0,95 | 0,02 | 0,37 | 0,05 | 0,96 | | Data della prova | 0,86 | 0,82 | 1,04 | 0,30 | 2,11 | 0,71 | 2,96 | 0,003 | | Anno | – | – | – | – | 0,25 | 0,36 | 0,71 | 0,48 | | Specie di zanzare*sesso | -1,37 | 0,69 | -1,99 | 0,047 | 0,28 | 0,56 | 0,60 | 0,62 | | Specie di zanzare*stato di infezione | 0,83 | 0,70 | 1,19 | 0,23 | -0,44 | 0,57 | -0,77 | 0,44 | | Varianza spiegata (R2) | 0,20 | | | | 0,07 | | | |
Abbreviazione: ES, errore standard
Discussione
Comprendere le cause dei modelli di puntura delle zanzare non casuali è fondamentale per comprendere le dinamiche di trasmissione del Plasmodium aviario e di altri patogeni trasmessi da vettori [13]. Questo studio ha esaminato come le caratteristiche aviarie (massa corporea, sesso, stato di infezione da Plasmodium) in due specie di uccelli influenzano i tassi di puntura di due specie di zanzare potenzialmente coinvolte nella trasmissione della malaria aviaria [32]. Studi futuri dovrebbero anche considerare fattori come le dimensioni del pasto di sangue, che potrebbero influenzare la trasmissione dei parassiti.
L’Oc. caspius mammifilo ha mostrato tassi di puntura più elevati sulle taccole rispetto alla Cx. pipiens ornitofila, mentre non è stata trovata alcuna differenza significativa per i passeri domestici. Sebbene l’Oc. caspius si nutra principalmente di mammiferi, gli uccelli (inclusi polli e passeri domestici) costituiscono il 9,1-19,9% dei loro pasti di sangue [6, 49], in contrasto con la Cx. pipiens, dove gli uccelli rappresentano l’85,1-91,67% dei pasti di sangue [6]. I biotipi di Cx. pipiens non sono stati considerati, sebbene esistano variazioni nelle preferenze alimentari [50]. Tuttavia, le zanzare sono state raccolte in un’area in cui coesistono entrambi i biotipi (Cx. pipiens pipiens e Cx. pipiens molestus) e ibridi. Uno studio precedente nel sud della Spagna non ha trovato differenze significative nelle proporzioni di pasti di sangue di uccelli tra i biotipi di Culex pipiens [45]. I nostri risultati confermano la capacità dell’Oc. caspius di nutrirsi di uccelli, in particolare quando la scelta dell’ospite è limitata. Ciò è rilevante in quanto il nostro studio si concentra sui tassi di puntura, non sulle preferenze alimentari. A differenza della Cx. pipiens, l’Oc. caspius è considerata aggressiva e una seccatura per l’uomo [51], sebbene le prove sperimentali a supporto siano limitate. Le differenze nel tasso di puntura tra le specie potrebbero essere collegate ai tratti della storia della vita e alle esigenze riproduttive, in particolare alla disponibilità di fonti d’acqua. L’Oc. caspius si basa sui cicli delle maree e sulle aree allagate temporanee per lo sviluppo larvale [52], mentre la Cx. pipiens utilizza fonti d’acqua più permanenti [53], potenzialmente rendendo il loro ciclo di vita meno vincolato nel tempo. Anche i modelli di attività differenziale potrebbero contribuire, con l’Oc. caspius che raggiunge il picco durante il giorno e la Cx. pipiens di notte/tramonto [49]. Mentre ciò potrebbe spiegare le differenze tra le specie, i tassi di puntura della Cx. pipiens qui sono simili a quelli degli esperimenti notturni [30]. Le variazioni climatiche stagionali influenzano la fenologia dell’ospite e del vettore, potenzialmente influenzando le interazioni ospite-vettore. Abbiamo osservato un aumento dei tassi di puntura delle zanzare sui passeri domestici dalla primavera all’autunno. Edman [54] ha riportato cambiamenti stagionali nei modelli di alimentazione del Culex nigripalpus. Nel nostro studio, questo effetto sembra specifico dell’assemblaggio ospite-zanzara, osservato solo in una specie di uccello. Tuttavia, la rilevanza di questa variabile è bassa, spiegando solo il 7% della varianza.
Le differenze nei modelli di puntura che appaiono solo con le taccole, l’ospite più grande, suggeriscono un legame con le quantità di emissione di segnali. La stimolazione visiva e termosensoriale diventa più importante per le zanzare più vicine agli ospiti. Segnali sensoriali multipli possono aumentare il successo dell’alimentazione [3]. Le taccole più grandi possono emettere più attrattivi (CO2, calore, odori) rispetto ai passeri domestici, causando le differenze osservate.
Studi precedenti mostrano una correlazione positiva tra la massa corporea dell’ospite e i tassi di puntura degli insetti succhiatori di sangue [19, 55], in genere nei confronti interspecifici. Come previsto, l’Oc. caspius ha punto le taccole più grandi più dei passeri domestici, sebbene la Cx. pipiens non abbia mostrato differenze significative. L’area della pelle esposta, solitamente legata alla massa corporea, può influenzare il successo dell’alimentazione delle zanzare [56]. La massa corporea è un fattore chiave nella prevalenza del virus del Nilo occidentale negli uccelli [57]. Yan et al. [58
